OXIGENO, HIDRÓGENO Y LÍQUIDOS
OXIGENO E HIDRÓGENO
INTRODUCCIÓN
en este trabajo hablaremos un poco sobre el estado natural del oxigeno e hidrógeno, sus propiedades físicas y químicas, combustión, sus llamas, como se obtienen y conocer aplicaciones y usos de cada uno.
El hidrógeno es un gas incoloro, inoloro e insípido, compuesto de moléculas diatomicas, H2. Es uno de los constituyentes principales del agua y de toda la materia orgánica, y esta distribuido de manera amplia no solo en la tierra sino en todo el universo
El oxigeno es un elemento químico gaseoso, símbolo O, numero atómico 8 y peso atómico 16. Es de gran interés por ser el elemento esencial en los procesos de respiración de la mayor parte de las células vivas y en los procesos de combustión.
OBJETIVO:
Definir el estado natural del oxigeno y del hidrógeno, así mismo buscar sus propiedades físicas y químicas.
Descubrir como se obtiene y recolecta el oxigeno e hidrógeno en la naturaleza, y la combustión de cada uno.
MARCO TEÓRICO
- OXIGENO:
El oxigeno disuelto adecuado se necesita para una buena calidad del agua. El oxigeno es un elemento necesario para todas las formas de vida. Los procesos de purificación naturales de la corriente requiere niveles de oxigeno adecuados para facilitar las formas de vida aerobicas. Mucho del oxigeno disuelto en el agua viene de la atmósfera. Después de la disolución en la superficie, el oxigeno se distribuye por la corriente y la turbulencia. las algas y plantas acuáticas también ceden oxigeno al agua mediante la fotosíntesis.
El principal factor que contribuye a los cambios en los niveles de oxigeno disuelto es el crecimiento de residuos orgánicos. El decaimiento de los residuos orgánicos. La temperatura, la presión y la salinidad afectan la capacidad del agua para disolver el oxigeno.
ESTADO NATURAL
El oxígeno gaseoso se condensa formando un líquido azul pálido fuertemente magnético. El oxígeno sólido de color azul pálido se obtiene comprimiendo el líquido. La masa atómica del oxígeno es 15,9994; a la presión atmosférica, el elemento tiene un punto de ebullición de -182,96 °C, un punto de fusión de -218.4 °C y una densidad de 1,429 g/l a 0 °C.
Se encuentra en todos los tejidos vivos. Casi todas las plantas y animales, incluyendo los seres humanos, requieren oxígeno, ya sea en estado libre o combinado, para mantenerse con vida.
Se conocen tres formas estructurales del oxígeno: el oxígeno ordinario, que contiene dos átomos por molécula y cuya fórmula es O2; el ozono, que contiene tres átomos por molécula y cuya fórmula es O3, y una forma no magnética azul pálida, el O4, que contiene cuatro átomos por molécula, y se descompone fácilmente en oxígeno ordinario
PROPIEDADES FÍSICAS
En condiciones normales de presión y temperatura (STP), el oxigeno se encuentra en estado gaseoso formando moléculas diatónicas (O2). Al igual que el hidrógeno, no posee propiedades organolépticas, es decir es incoloro, inodoro e insípido.
El oxigeno se condensa a -183oC en un líquido azul pálido. Se solidifica a -219oC en un sólido blando azulado. Para ambos estados de agregación es muy paramagnético, es decir, sus regiones más probables de encontrar electrones u orbitales tienden a alinearse paralelamente cuando están en presencia de un campo magnético.
PROPIEDADES QUÍMICAS
Nombre : Oxígeno
Número atómico :8
Valencia : 2
Estado de oxidación : - 2
Electronegatividad : 3,5
Radio covalente (Å) : 0,73
Radio iónico (Å) : 1,40
Configuración electrónica : 1s22s22p4
Primer potencial de ionización (eV) : 13,70
Masa atómica (g/mol) : 15,9994
Densidad (kg/m3) : 1.429
Punto de ebullición (ºC) : -183
Punto de fusión (ºC) : -218,8
Descubridor : Joseph Priestly 1774
COMBUSTIÓN:
En la combustión una sustancia química reacciona rápidamente con oxígeno produciendo calor y luz. Los productos típicos de una reacción de combustión son CO2, H2O, N2 y óxidos de cualquier otro elemento presente en la muestra original.
Un ejemplo típico de combustión es la oxidación del metano según el proceso

Las reacciones de combustión a menudo transcurren mediante la formación de radicales libres, moléculas o iones electrónicamente excitados que emiten fluorescencia dando color a la llama, o también formando pequeñas partículas de sólido (ejem. carbón) cuya incandescencia puede observarse.
La combustión es un proceso muy importante en nuestras vidas pues los combustibles se usan como fuente de energía, gasolina, gas, etc., en los medios de transportes, coches, aviones o en los hogares o industrias. Aunque hoy en día el proceso de la combustión esta bien entendido este proceso ha sido uno de los grandes enigmas desde los tiempos antiguos hasta finales del siglo XVIII en que Lavoisier (1743–-1794) consiguió dilucidar su naturaleza química.
LLAMA DEL OXIGENO:
Cuando se produce la combustión de un elemento inflamable en una atmósfera rica en oxígeno, se observa una emisión de luz, que puede llegar a ser intensa, denominada llama.
Todas las reacciones de combustión son muy exotérmicas y desprenden gran cantidad de energía en forma de calor. La llama es provocada por la emisión de energía de los átomos de algunas partículas que se encuentran en los gases de la combustión, al ser excitados por el intenso calor generado en este tipo de reacciones.
OBTENCIÓN DEL OXIGENO:
Dado que constituye aproximadamente el 21% de la atmósfera, se obtiene industrialmente mediante destilación fraccionada del aire líquido. En la parte alta de la columna de destilación se separa el nitrógeno gaseoso que es el componente más volátil, mientras que el oxígeno se recoge líquido por la base de la misma. En la actualidad los procesos de licación y destilación se producen simultáneamente, ya que el nitrógeno gaseoso frio que se recoge en la cabecera del destilador se utiliza para enfriar el aire en intercambiadores de calor, que queda parcialmente licuado con un contenido de oxígeno muy superior al 21%.
Otra forma de obtención del oxígeno es la electrolisis del agua a la que previamente se le añade ácido sulfúrico o sosa con el objeto de hacerla conductora. En este proceso se desprende hidrógeno en el cátodo y oxígeno en el ánodo.
En el laboratorio, el oxígeno se obtiene por descomposición de algunos de sus compuestos. Los óxidos de plata y de mercurio se descomponen térmicamente para dar oxígeno y el metal correspondiente. El clorato de potasio (KClO3 ) se descompone en cloruro de potasio y oxígeno en una reacción catalizada por el dióxido de manganeso. El peróxido de sodio (Na2O2) se descompone por la acción del agua generando hidróxido de sodio y oxígeno.
APLICACIONES Y USOS :
El oxígeno tiene diversos múltiples funciones en nuestro mundo, desde algo tan elemental como la respiración, hasta aplicaciones en la ciencia:
Respiración: Las plantas y animales dependen del oxígeno para respirar. Los humanos y animales inhalan oxígeno a los pulmones, o en el caso de los anfibios, a través de las branquias o la piel. El oxígeno le da energía a las células de la sangre antes de ser liberado como dióxido de carbono.
En medicina: Suministrándolo como suplemento a pacientes con dificultades respiratorias,El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, facilitando el trabajo de bombeo del corazón.
En cohetes: En su forma líquida, el oxígeno es usado como un agente desoxidante en misiles y cohetes. El tanque exterior de gasolina que se usa para elevar a una nave espacial fuera del atmósfera contiene cerca de 145.000 galones de oxígeno líquido (548 884 litros) y cerca de 390.000 galones de hidrógeno líquido (1.476.310 litros). Los dos elementos reacciones en los motores principales para generar un impulso máximo de 512.000 libras (232.239 kilos).
Metalurgia: La producción del acero depende del oxígeno. Se usa en un horno alto para convertir el carbono en dióxido de carbono, lo que reduce el óxido de hierro en hierro puro. El oxígeno también es usado en los sopletes de corte y soldadura. El oxígeno reacciona con el hidrógeno o el acetileno en los sopletes, los que se pueden calentar a más de 5.000 grados F (2760 grados centígrados). Estos sopletes pueden cortar o soldar la mayoría de metales.
Ciencia: Los paleoclimatólogos miden la relación entre el oxígeno-18 y el oxígeno-16 en los esqueletos y exoesqueletos de los organismos marinos para determinar cómo era el clima hace millones de años. Las moléculas de agua de mar que contienen el isótopo más ligero, el oxígeno-16, se evaporan a un ritmo ligeramente mayor que las moléculas que contienen oxígeno-18 (un 12 % más pesado); esta disparidad se incrementa a bajas temperaturas.
- HIDRÓGENO:
El hidrógeno elemental es muy escaso en la tierra y es producido industrialmente a partir de hidrocarburos como,el metano. la mayor parte del hidrógeno se obtiene en el lugar y en el momento en el que se necesita. el hidrógeno puede obtenerse a partir del agua por un proceso de electrosis.
El hidrógeno como portador de energía recalca sus beneficios para el ambiente, no produce contaminación ni consume recursos naturales. el hidrógeno se toma del agua y luego se oxida y se devuelve al agua.no hay productos secundarios ni tóxicos de ningún tipo que puedan producirse en este proceso. el hidrógeno se usa para producir fertilizantes agrícolas, margarinas y plásticos.
ESTADO NATURAL:
El hidrógeno es el elemento más abundante del Universo. En efecto, la mayoría de las estrellas son predominantemente de hidrógeno (el Sol tiene aproximadamente un 90% de hidrógeno). En cuanto a la Tierra, su abundancia es menor. En estado libre, se encuentra en pequeñas cantidades en la atmósfera, así como en los gases que se desprenden de los volcanes y de los yacimientos de petróleo. En combinación, por el contrario, el hidrógeno es bastante común: en el agua constituye en 11,2% de su peso total; el cuerpo humano, que es aproximadamente dos terceras partes de agua, tiene un 10% de hidrógeno por peso; forma parte esencial de todos los organismos animales y vegetales, en los cuales entra en combinación con oxígeno, nitrógeno, carbono, etc. Finalmente, es un constituyente importante del petróleo y de los gases de combustibles naturales.
PROPIEDADES FÍSICAS:
El hidrógeno es un gas incoloro, inodoro e insípido a temperatura ambiente. Es el elemento más liviano que existe, siendo aproximadamente 14 veces menos pesado que el aire. Su molécula consiste de dos átomos de hidrógeno (H2) unidos por un enlace covalente. Posee tres isotopos, de los cuales el más abundante es el Protio (99.985%); el Deuterio tiene una abundancia de 0,02% y el tritio es tan escaso que de cada 109 átomos de hidrógeno hay uno de tritio.
El hidrógeno es fácilmente absorbido por ciertos metales finamente divididos, siendo los principales paladio, platino y oro. Por ejemplo, uno volumen de paladio finamente dividido puede adsorber aproximadamente 850 volumen es de Hidrógeno a temperatura ambiente. El hidrógeno absorbido es muy activo químicamente.
PROPIEDADES QUÍMICAS:
- Tiene un peso atómico de 100974 uma.
- Posee un estado de oxidación de +1, -1.
- Completa su nivel de valencia con un electrón capturada, para así poder producir el anión H^-.
- Se combina con los metales alcalinos y alcalinotérreos (menos con el berilio y magnesio), a través de enlaces iónicos.
- Forma enlaces tipo covalentes, con los no metales.
- Forma enlaces metálicos con los elementos de transición.
- El hidrógeno, H^+, siempre se encuentra asociado a otro elemento, menos en el estado gaseoso.
- Posee una estructura cristalina hexagonal.
- Reacciona con la gran mayoría de los elementos de la tabla periódica.
COMBUSTIÓN DEL HIDRÓGENO:
El combustible de hidrógeno es un combustible de emisión cero que usa celdas electroquímicas o la combustión en motores internos, para propulsar vehículos y dispositivos eléctricos. También es usado en la propulsión de naves espaciales y potencialmente puede ser producido en masa y comercializado para su uso en vehículos terrestres de pasajeros y aeronaves.
El hidrógeno está ubicado en el primer grupo y el primer período de la tabla periódica, es el primer elemento de la tabla periódica, convirtiéndolo en el elemento más liviano en el universo. El hidrógeno no es ni un metal ni un no metal pero aún es considerado un no metal. Actúa como un metal cuando es comprimido a altas densidades.
Dado que el gas de hidrógeno es tan ligero, se eleva en la atmósfera y por lo tanto raramente es encontrado en su forma pura, H2. En una llama de gas de hidrógeno puro, quemándose en el aire, el hidrógeno (H2) reacciona con el oxígeno (O2) para formar agua (H2O) y liberar calor.
- 2H2(g) + O2(g) → 2H2O(g)
LA LLAMA DEL HIDRÓGENO:
OBTENCIÓN:
El hidrógeno, es un elemento químico que se representa con el símbolo H, cuyo número atómico es de 1. Cuando se encuentra en condiciones normales, ya sea de temperatura, como de presión, se presenta como un gas diatómico, sin color, sin sabor, y sin olor, de carácter no metálico.
El hidrógeno se obtiene mediante diversos procesos:
- electrólisis
- reformado
- gasificación
- ciclos termoquímicos
- producción biológica
APLICACIONES Y USOS
- Producción de ácido clorhídrico (HCl);
- Combustible para cohetes
- Enfriamiento de rotores en generadores eléctricos en puestos de energía, visto que el hidrógeno posee una elevada conductividad térmica;
- En estado líquido es utilizado en investigaciones criogénicas, incluyendo estudios de superconductividad.
LOS LÍQUIDOS

INTRODUCCIÓN:
Los líquidos son sustancias que presentan un estado de agregación específico, en el que sus partículas se encuentran lo suficientemente juntas para mantener una cohesión mínima (no tanta como los sólidos, pero mucho más que los gases) y lo suficientemente sueltas para permitir al mismo tiempo la fluidez.
Este estado de la materia suele considerarse un punto intermedio entre las cosas sólidas y las gaseosas, y por lo general es resultado de la inyección de energía a las primeras (fusión) o la sustracción de energía a las segundas (condensación). Otro camino posible para ello es la variación de las condiciones de presión. En todo caso, las partículas de un líquido están a medio camino entre la rigidez de lo sólido y la dispersión de lo gaseoso.
Los líquidos son difíciles de comprimir y carecen de forma determinada, a la par que presentan propiedades únicas como la tensión superficial. Muchas sustancias son líquidas en su estado natural (como el agua), mientras que otras pueden serlo sólo bajo condiciones específicas.
OBJETIVO:
obtener mas conocimiento acerca de los líquidos y Conocer sus propiedades incluyendo evaporación, presión, ebullición, viscosidad y demás aspectos.
MARCO TEÓRICO
El estado líquido es el que menos abunda de forma natural ya que solo encontramos en la naturaleza como sustancias líquidas el agua, petróleo, mercurio, bromo y el francio, los otros líquidos que existen han sido creados por el hombre. Sin embargo estamos constituidos por aproximadamente 60% de agua y necesitamos consumir casi 2,5 L / día (Phillips 2001).
PROPIEDADES
- EVAPORACIÓN:
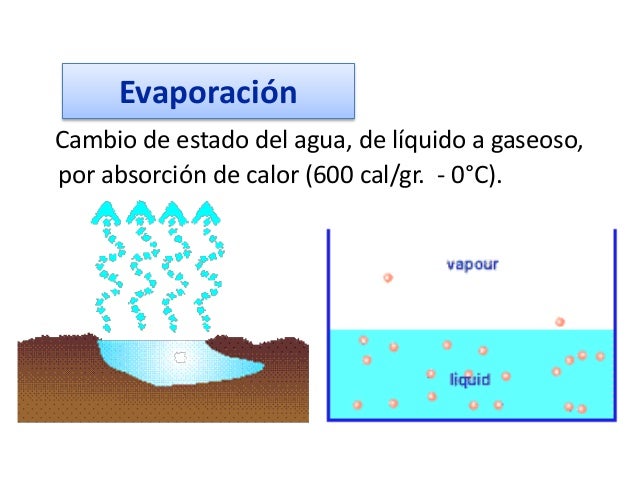
La evaporación es el proceso por el cual las moléculas en estado líquido (por ejemplo, el agua) se hacen gaseosas espontáneamente (ej.: vapor de agua). Es lo opuesto a la condensación. Generalmente, la evaporación puede verse por la desaparición gradual del líquido cuando se expone a un volumen significativo de gas. Por término medio, las moléculas no tienen bastante energía para escaparse del líquido, porque de lo contrario el líquido se convertiría en vapor rápidamente. Cuando las moléculas chocan, se transfieren la energía de una a otra en grados variantes según el modo en que chocan.
Los líquidos que no parecen evaporarse visiblemente a una temperatura dada en un gas determinado (p.ej., el aceite de cocina a temperatura ambiente) poseen moléculas que no tienden a transferirse la energía de una a otra como para darle "la velocidad de escape" (la energía calórica) necesaria para convertirse en vapor. Sin embargo, estos líquidos se evaporan, pero el proceso es mucho más lento y considerablemente menos visible.
- PRESIÓN DE VAPOR
La presión de vapor es la presión de la fase gaseosa o vapor de un sólido o un líquido sobre la fase líquida en una ampolla cerrada al vacío, para una temperatura determinada, en la que la fase líquida y el vapor se encuentran en equilibrio dinámico; su valor es independiente de las cantidades de líquido y vapor presentes mientras existan ambas. Este fenómeno también lo presentan los sólidos; cuando un sólido pasa al estado gaseoso sin pasar por el estado líquido (proceso denominado sublimación o el proceso opuesto, llamado sublimación inversa o deposición) también hablamos de presión de vapor. En la situación de equilibrio, las fases reciben la denominación de líquido saturado y vapor saturado. Esta propiedad posee una relación inversamente proporcional con las fuerzas moleculares, debido a que cuanto mayor sea el módulo de las mismas, mayor deberá ser la cantidad de energía entregada (ya sea en forma de calor u otra manifestación) para vencerlas y producir el cambio de estado.
- EBULLICIÓN
La ebullición es un proceso físico en el que un líquido pasa a estado gaseoso. Se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión. Si se continúa calentando el líquido, éste absorbe el calor, pero sin aumentar la temperatura el calor se emplea en la conversión de la materia en estado líquido al estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. El calor puesto en juego durante el calentamiento de la masa del líquido se denomina calor sensible, y al que se manifiesta durante el cambio de estado se lo llama calor latente de ebullición o vaporización.

- VISCOSIDAD
La viscosidad de un fluido es una medida de su resistencia a las deformaciones graduales producidas por tensiones cortantes o tensiones de tracción. La viscosidad corresponde con el concepto informal de "espesor". Por ejemplo, la miel tiene una viscosidad mucho mayor que el agua.
La viscosidad de un liquido puede ser determinado su velocidad de flujo a través
de un bulbo capilar.
Para el volumen (v) de un liquido que fluye a través de un tubo capilar de radio r,
longitud L, en un tiempo t, bajo una diferencia de presión P; su viscosidad N es
expresada mediante la ecuación de Poiseuille:
N = (P)(π)(r)(t) / 8vL

- TENSIÓN SUPERFICIAL
se denomina tensión superficial de un líquido a la cantidad de energía necesaria para aumentar su superficie por unidad de área. Esta definición implica que el líquido presenta una resistencia al aumentar su superficie, lo que en efecto permite a algunos insectos, como el zapatero (Gerris lacustris), poder desplazarse por la superficie del agua sin hundirse.
La tensión superficial (una manifestación de las fuerzas intermoleculares en los líquidos), junto a las fuerzas que se dan entre los líquidos y las superficies sólidas que entran en contacto con ellos, da lugar a la capilaridad. Como efecto tiene la elevación o depresión de la superficie de un líquido en la zona de contacto con un sólido.
La tensión superficial se debe a que las fuerzas que afectan a cada molécula son diferentes en el interior del líquido y en la superficie. Así, en el seno de un líquido cada molécula está sometida a fuerzas de atracción que en promedio se anulan. Esto permite que la molécula tenga una energía bastante baja. Sin embargo, en la superficie hay una fuerza neta hacia el interior del líquido. Rigurosamente, si en el exterior del líquido se tiene un gas, existirá una mínima fuerza atractiva hacia el exterior, aunque en la realidad esta fuerza es despreciable debido a la gran diferencia de densidades entre el líquido y gas.
EL AGUA
- ESTRUCTURA MOLECULAR:
La molécula de agua adopta una geometría no lineal, con los dos átomos de hidrógeno formando un ángulo de 104,45 grados entre sí. Esta configuración, junto con la mayor electronegatividad del átomo de oxígeno, le confieren polaridad a la molécula, cuyo momento dipolar eléctrico es de 6,2 × 10−30 C m.
- PROPIEDADES QUÍMICAS Y BIOLÓGICAS

- ELECTROLISIS DEL AGUA
La electrólisis del agua es la descomposición del agua (H2O) en los gases oxígeno(O2) e hidrógeno (H2) por medio de una corriente eléctrica continua, suministrada por una fuente de alimentación, una batería o una pila, que se conecta mediante electrodos al agua. Para disminuir la resistencia al paso de corriente a través del agua esta se suele acidular añadiendo pequeñas alícuotas de ácido sulfúrico o bien añadiendo un electrolito fuerte como el hidróxido de sodio, NaOH.
En este proceso se le llama cátodo al electrodo que aporta la carga negativa a la disolución acuosa o electrólito fundido, mientras al otro electrodo que es el responsable de la carga negativa se le llama ánodo.
La electrólisis del agua permite que se obtenga los elementos químicos que la componen de forma pura o sea el hidrógeno(H) a través del cátodo y el oxígeno(O) a través del ánodo, ambos en estado gaseoso.
Este proceso se le puede aplicar al agua dulce y a la salada obteniéndose resultados diferentes teniendo en cuenta las sustancias producto. En el caso del agua salada las sustancias que se obtienen a través del ánodo y el cátodo son el cloro (Cl) y el hidrógeno (H) respectivamente ambos en estado gaseoso, quedando al final del proceso una disolución de hidróxido de sodio (NaOH).
- AGUAS DURAS
Se conoce como agua dura aquella que contiene un alto nivel de minerales, concretamente de sales de magnesio y calcio. Este tipo de aguas suelen ser las subterráneas en suelos calcáreos, que elevan los niveles de cal y magnesio, entre otros.
- AGUAS PESADAS
Es una clase de agua algo más pesada ( tiene mayor densidad) que la común. Un litro de agua pesada pesa 1.105 gramos, mientras que un litro de agua común pesa 1.000 gramos. Se denomina agua pesada (D2O) al óxido de deuterio.
La fórmula química del agua deuterada, óxido de deuterio o agua pesada es: D2O o 2H2O.
- PERÓXIDO DE HIDRÓGENO H2O2
también conocido como agua oxigenada, dioxogen, óxido de agua o dioxidano, es un compuesto químico con características de un líquido altamente polar, fuertemente enlazado con el hidrógeno tal como el agua, pero que en general se presenta como un líquido ligeramente más viscoso que ésta. Es conocido por ser un poderoso oxidante.
A temperatura ambiente es un líquido incoloro con olor penetrante e incluso desagradable. Pequeñas cantidades de peróxido de hidrógeno gaseoso se encuentran naturalmente en el aire. El peróxido de hidrógeno es muy inestable y se descompone lentamente en oxígeno y agua con liberación de gran cantidad de calor. Su velocidad de descomposición puede aumentar mucho en presencia de catalizadores. Aunque no es inflamable, es un agente oxidante potente que puede causar combustión espontánea cuando entra en contacto con materia orgánica o algunos metales, como el cobre, la plata o el bronce.
CONTAMINACIÓN DEL AGUA
La contaminación hídrica o la contaminación del agua es una modificación de esta, generalmente provocada por el ser humano, que la vuelve impropia o peligrosa para el consumo, la industria, la agricultura, la pesca y las actividades, así como para los animales.
Aunque la contaminación de las aguas puede provenir de fuentes naturales, como la ceniza de un volcán, la mayor parte de la contaminación actual proviene de actividades humanas.
El desarrollo y la industrialización suponen un mayor uso de agua, una gran generación de residuos, muchos de los cuales van a parar al agua y el uso de medios de transporte fluvial y marítimo que en muchas ocasiones, son causa de contaminación de las aguas por su petróleo o combustible. Las aguas superficiales son en general más vulnerables a la contaminación de origen antrópico que las aguas subterráneas, por su exposición directa a la actividad humana. Por otra parte, una fuente superficial puede restaurarse más rápidamente que una fuente subterránea a través de ciclos de escorrentía estacionales. Los efectos sobre la calidad serán distintos para lagos y embalses que para ríos, y diferentes para acuíferos de roca o arena y grava de arena.
La presencia de contaminación genera lo que se denominan “ecosistemas forzados”, es decir ecosistemas alterados por agentes externos, desviados de la situación de equilibrio previa obligados a modificar su funcionamiento para minimizar la tensión a la que se ven sometidos.
WEDGRAFIA:
- PARA EL OXIGENO:
https://www.monografias.com/docs/Propiedades-Quimicas-y-Fisicas-Del-Oxigeno-PKY7GFJDU2Y
https://marte120.blogspot.com/2010/10/propiedades-fisicas-y-quimicas-del_23.html
https://www.investigacionyciencia.es/blogs/fisica-y-quimica/10/posts/la-combustin-y-el-oxigeno-10170
https://es.wikipedia.org/wiki/Llama_(qu%C3%ADmica)
https://quimicaoxigenojmd.blogspot.com/2012/02/como-se-obtiene-industrialmente-como-se.html
http://literaturaquimicaeloxigeno.blogspot.com/2015/05/usos-y-aplicaciones.html
- HIDRÓGENO:
https://www.enciclopediadetareas.net/2010/09/propiedades-fisicas-y-quimicas-del.html
https://quimica.laguia2000.com/general/propiedades-del-hidrogeno
https://quimica.laguia2000.com/conceptos-basicos/aplicaciones-del-hidrogeno
https://neetescuela.org/propiedades-y-usos-del-hidrogeno/
- LÍQUIDOS
https://www.caracteristicas.co/liquidos/
https://liquidos.wordpress.com/2007/10/21/marco-teorico/
https://www.ciclohidrologico.com/evaporacin
https://es.wikipedia.org/wiki/Presi%C3%B3n_de_vapor
https://es.wikipedia.org/wiki/Ebullici%C3%B3n
http://www.geocities.ws/todolostrabajossallo/fico12
http://www.sc.ehu.es/sbweb/fisica/fluidos/tension/introduccion/introduccion.htm
- EL AGUA
https://agua.org.mx/biblioteca/estructura-molecular-del-agua/
http://www.atl.org.mx/index.php?option=com_content&view=article&id=1992:propiedades-quimicas-del-agua&catid=72:ciencias-naturales&Itemid=480
https://www.ecured.cu/Electr%C3%B3lisis_del_agua
https://www.ecured.cu/Agua_dura
https://www.ecured.cu/Agua_pesada
https://es.wikipedia.org/wiki/Per%C3%B3xido_de_hidr%C3%B3geno
https://es.wikipedia.org/wiki/Contaminación_hídrica
BUEN TRABAJO 4,5
ResponderBorrar